- 現在進めている研究です。
IRPはmRNA結合タンパク質ですから、細胞質に存在します。鉄は細胞外から取り込まれ、ミトコンドリアで鉄-硫黄クラスター、ヘムに組み込まれた後、ミトコンドリアから細胞質に運ばれてIRPなどのタンパク質に配位します。(図1)
それら鉄補欠分子族の細胞内動態、輸送機構、とりわけヘムのそれはほとんど明らかでないのが現状です。私たちは出芽酵母の遺伝学、プロテオーム、メタボローム的手法を用いて、ヘムを中心にこの問題に取り組んでいます。(図2)
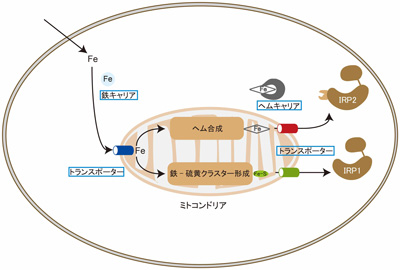
図1 : 細胞内の鉄、ヘム、鉄-硫黄クラスターの動態
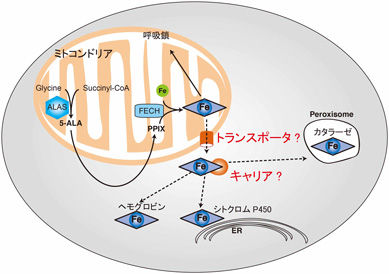
図2 : 細胞内ヘム輸送機構
過剰な鉄は鉄貯蔵タンパク質であるフェリチンに貯蔵されます。フェリチンに貯蔵された鉄はFe3+で安定であり、毒性を発揮しません。細胞が鉄過剰→鉄欠乏になったときにはフェリチンはオートファジーによりリソソームに運ばれて分解して鉄を取り出します。(図3)
鉄過剰時にはフェリチンは安定であると信じられてきましたが、正常細胞では鉄過剰の時にもフェリチンはリソソームに運ばれて分解されることを明らかにしましたが、そのメカニズムはオートファジーとは異なるメカニズムであることを示しました。(図4)
現在鉄欠乏時、鉄過剰時にフェリチンがリソソームに輸送されルメカニズムについて詳細に解析を進めています。
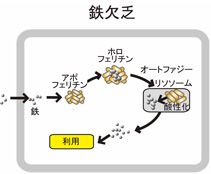
図3 : 鉄欠乏時のフェリチンの動態と鉄利用
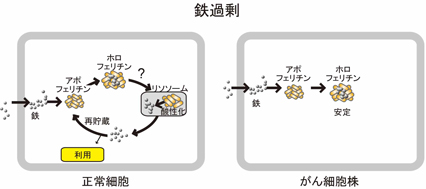
図4 : 鉄過剰時のフェリチンの動態 - がん細胞株と正常細胞での違い
私たちは細胞の鉄感知におけるミトコンドリアの重要性を示してきました。鉄から俯瞰すれば、ミトコンドリアは鉄を鉄のタンパク質への主たる結合様式であるヘム、鉄-硫黄クラスターに加工する工場です。細胞の鉄感知においてミトコンドリアはが重要なのはおそらく、ヘムや鉄-硫黄クラスターが細胞にとって不可欠で十分に供給できないと困るからでしょう。鉄は毒性を持ちますから、当然ミトコンドリアダメージを生じるはずです。鉄はエネルギー産生などに係わりますから、当然、ミトコンドリアでのATP産生と細胞の鉄動態とは関連があるはずです。
非常に漠然としているかもしれませんが、鉄とミトコンドリアをキーワードにいろんな研究を模索しています。残念ですが、詳しくは書けませんけど..。
- 以下は私たちがこれまで行ってきた研究です。研究は一応終了ですけど、
a) 出芽酵母の鉄代謝制御メカニズムの研究
出芽酵母においても鉄は必須の栄養素であり、出芽酵母の鉄、鉄補欠分子族の研究からフリードリッヒ失調症の原因遺伝子であるフラタキシンの機能が明らかになるなど、鉄代謝研究の有用なモデル生物になっています。出芽酵母の鉄代謝は鉄代謝応答性転写因子Aft1が鉄欠乏時にのみ活性化されることによって制御されています。私たちはAft1の発見者である共同研究者であった故・岩井裕子博士とともに、Aft1の鉄依存性活性制御機構の解析を進め、Aft1pは鉄依存的な核外移行によって制御されること、さらに、Aft1は鉄依存的に2量体が形成されることによって核外輸送担体であるMsn5と結合する事を示してきました。さらに、Aft1の鉄依存的な核外移行にはミトコンドリアでの鉄-硫黄クラスター生成が必須であることを示しました。高等真核細胞のみならず、出芽酵母においても細胞の鉄代謝調節におけるミトコンドリアの重要性を明確に出来たと思っています。
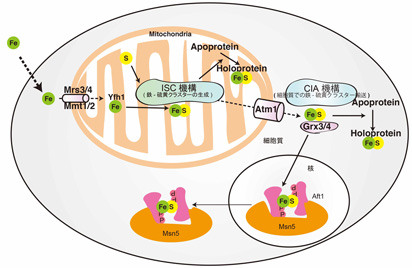
図5 : 出芽酵母の鉄感知メカニズム