LUBAC accelerates B-cell lymphomagenesis by conferring B cells resistance to genotoxic stress.
Blood 136(6): 684-697, 2020. DOI
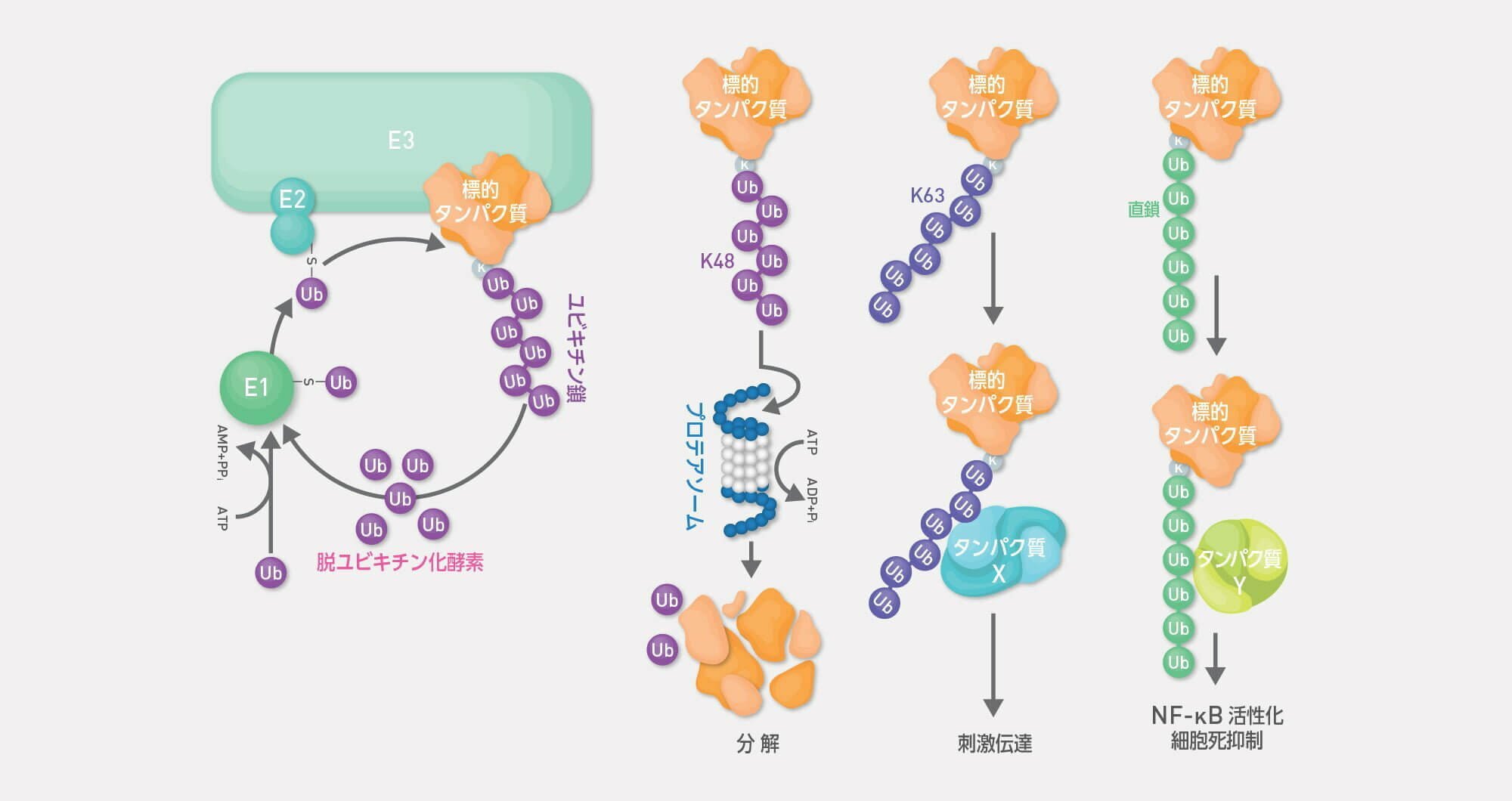
ユビキチンは図に示す3種類の酵素群によって、E3(ユビキチンリガーゼ)が選択的に認識する標的タンパク質に結合する翻訳後修飾因子です。
ユビキチン=タンパク質分解だと思っている方も多いと思いますが、今では多様な様式でタンパク質の機能を調節する可逆的な翻訳後修飾系であることが分かっています。
ユビキチン系が他の翻訳後修飾系と異なる重要な特徴は、
が挙げられます。
私たちは全く新しいタイプある直鎖状ユビキチン鎖を発見し、その機能解析と種々の疾患治療への展開を視野に研究を推進しています。
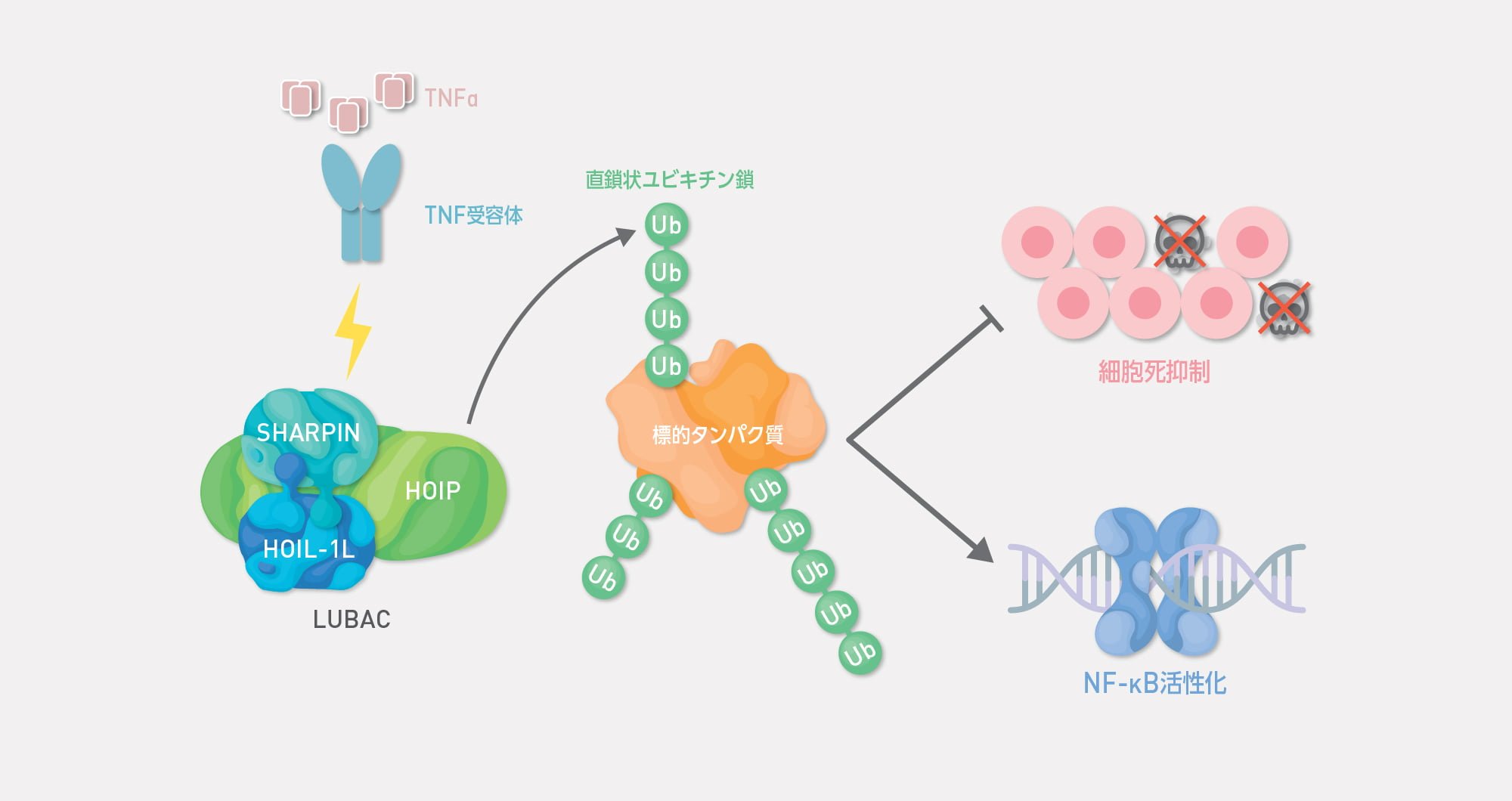
直鎖状ユビキチン鎖を生成できるのはLUBACユビキチンリガーゼ(E3)複合体だけであると考えられています。LUBACによって生成される直鎖状ユビキチン鎖は、TNF-αなどの種々の刺激依存的なNF-κBの活性化やプログラム細胞死抑制に関与しています。私たちはLUBACの制御機構の解明や新規標的タンパク質を同定することで、直鎖状ユビキチン鎖の新たな役割、疾患発症への寄与を探索しております。
Blood 136(6): 684-697, 2020. DOI
Nature Cell Biology 22(6): 663-673, 2020. DOI
Nature Commun. 10(1):3878, 2019. DOI
Cell Reports 23(4):1192-1204, 2018. DOI
J. Immunol. 200(10):3438-3449, 2018. DOI
Mol. Cell. Biol. 36:1569-1583, 2016. DOI
J. Immunol. 192:3793-3804, 2014.
Mol. Cell. Biol. 34:1322-1335, 2014.
Genes Cells. 19:254-272, 2014.
EMBO J. 32: 2463- 2476, 2013.
Proc. Natl. Acad. Sci. USA 108:20520-20525, 2011.
Nature 471:633-636, 2011.
Nature Cell Biology 11:123-132, 2009.
EMBO J. 25: 4877–4887, 2006.
Nature Cell Biology 5:336-340, 2003.
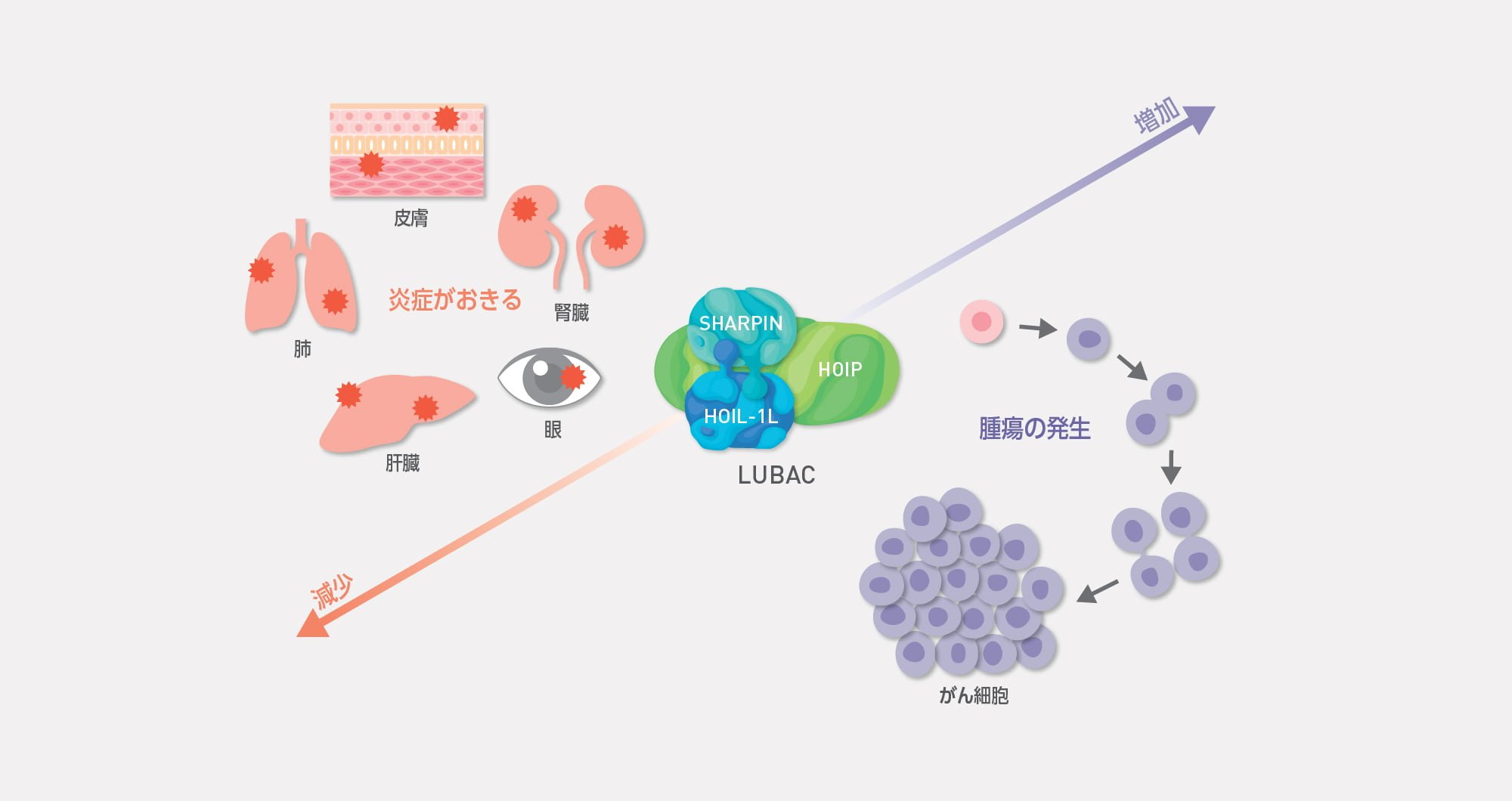
多くの免疫疾患・がんなどの炎症性疾患では、直鎖状ユビキチン鎖修飾機構が関わる細胞内シグナル伝達系が、その発症機序や組織内での炎症環境の維持・増悪化に重要な役割を果たすことが分かってきました。私たちは、臓器特異的なLUBACの機能亢進・欠損モデルなどを活用することで、さらに詳細な直鎖状ユビキチン鎖修飾機構の生理機能を組織・個体レベルで明らかにするとともに、炎症性疾患の病態形成へ働く新規メカニズムを様々な実験手法を用いて解析しています。
Blood 136(6): 684-697, 2020. DOI
Nature Commun. 10(1):3878, 2019. DOI
J. Immunol. 192:3793-3804, 2014.
Nature 471:633-636, 2011.
Nature 471:637-641, 2011.
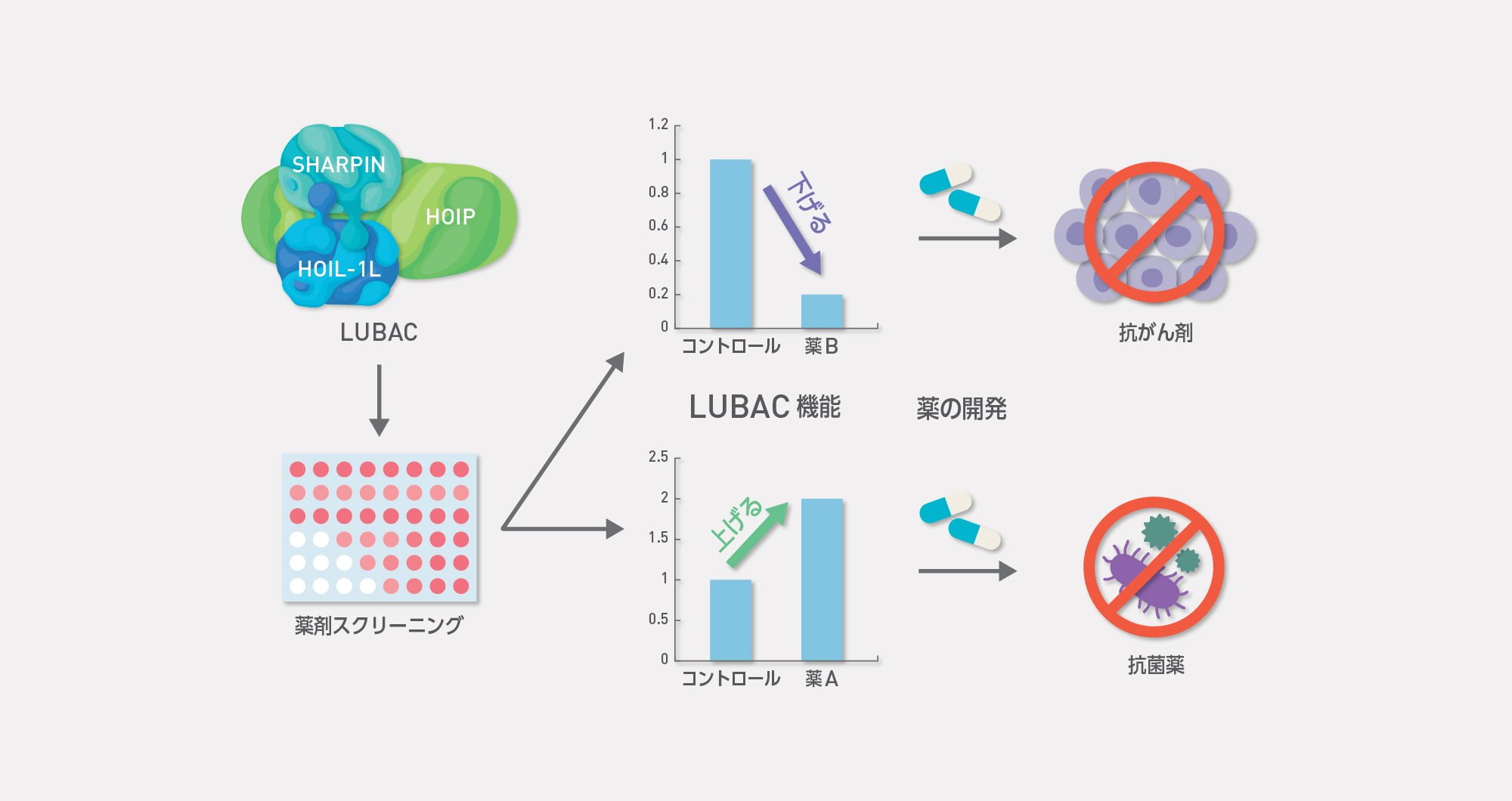
LUBACの機能亢進、低下が種々の疾患を惹起することが明らかになっています。私たちはLUBACを標的とした新規医薬品の開発を目指しています。LUBACの活性を阻害する薬剤は抗がん剤、上昇させる薬剤は抗菌薬になると考えられます。これまでの知見に基づき、LUBAC阻害剤、活性化剤取得のためのドラッグスクリーニングを行なっています。
Blood 136(6): 684-697, 2020. DOI
Cell Reports 23(4):1192-1204, 2018. DOI
ACS Chem Biol. 10:675-681, 2015.
Cancer Discovery 4:480-493, 2014.
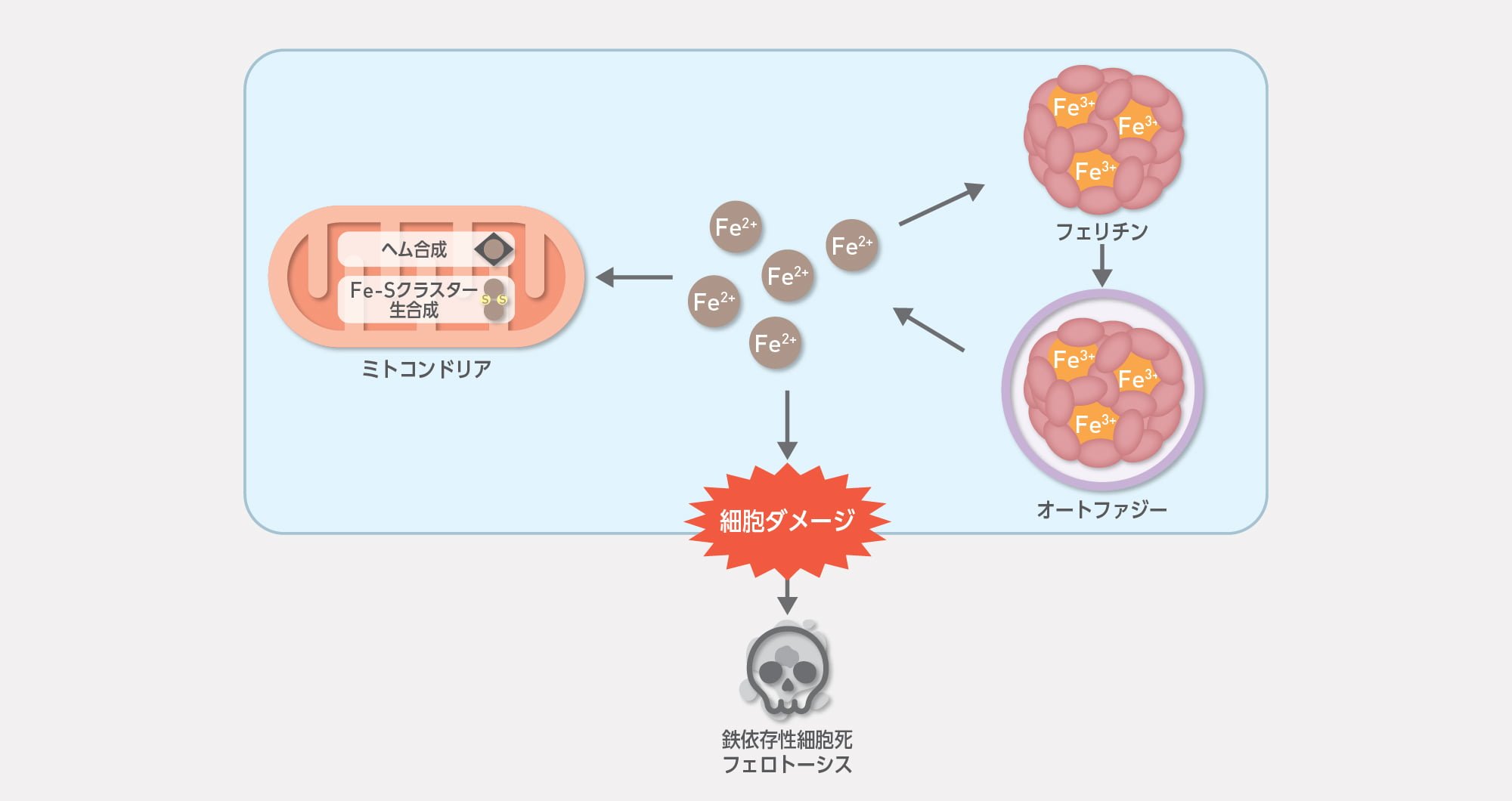
鉄は生命にとって必須の微量金属ですが、過剰に存在すると毒性を発揮するため細胞内の鉄は厳密に調整されています。私たちは鉄の加工場であるミトコンドリア、また鉄貯蔵タンパク質であるフェリチンの解析を通して、鉄恒常性の維持機構を解析しています。また、近年注目されている細胞死であるフェロトーシスに関しても、鉄の視点から解析することで従来知られていなかったフェロトーシスの分子機構を解析しています。
Neurosci. Lett. 588:29-35, 2015.
Mol. Cell. Biol. 32:4998-5008, 2012.
Mol. Cell. Biol. 31:2040-2052, 2011.
Cell Metabolism 14: 339–351, 2011.
Mol. Biol. Cell 18:2980-2990, 2007.
Molecular Cell 19:171-181, 2005.
Nature Cell Biology 5:336-340, 2003.
Proc. Natl. Acad. Sci. USA 95:4924-4928, 1998.
EMBO. J. 14:5350-5357, 1995.